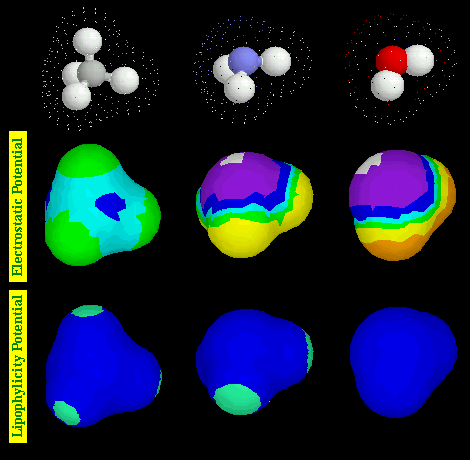
・Select / Display List / Generate Surface → Select / Display List / Color / Electrostatic Potential / Rasmol potential
・Select / Display List / Generate Surface → Select / Display List / Color / Molecular Lipophilicity Potential / Color MLP
※結合の手の数(原子価)
●上記の操作による表示画像例(以下は画像で,分子回転などはできません)