◆ 生体分子と水素結合 ◆
〜 生体内にも建築家がいる? 〜
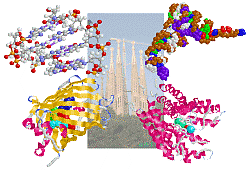
生体分子の機能を発言する高次構造は水素結合で保持されている!
上左:DNA部分構造例,上右:tRNA関連データ例(1ml5のChain B・C;コドンと遺伝暗号表参照)
下左:GFPの例(1hcj),下右:イオンチャネルタンパク質の例(1bl8)
※中央のサグラダ・ファミリアの画像は美学ホームページ主宰者から提供していただいた写真を加工したものです.
[TOPIC] 2003/10/04-12/14,東京都現代美術館で「ガウディ かたちの探求」展開催中 → フジテレビの情報(展覧会のみどころ)
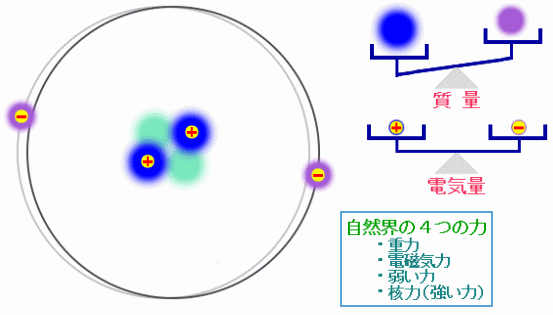
ある原子の構造の模式図と“自然界の4つの力”
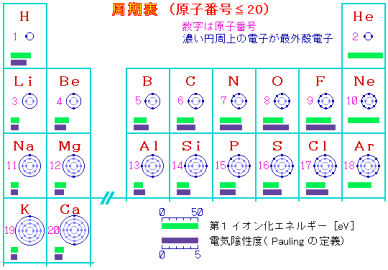
電気陰性度
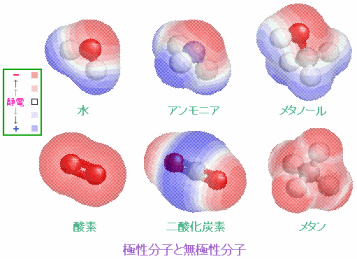
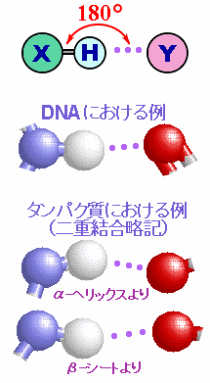
分子の極性・無極性(左;参考ページ)と水素結合の構造(右;最上段でX,Yは電気陰性度の大きい原子)




