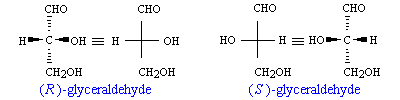
◎ 図1の各段の左右の分子は,それぞれ中央にある鏡に映ったような向きにしてあります.左右が同じものかどうか,マウスで分子を動かてみてください.特定の球(例えば2段目以下では赤色)が手前に来るようにし,うまく回転して残りの3つの色の球の並び方が同じか違うかを比べて見ればいいでしょう.自分で簡単な模型を作って確かめることもできます.
※ 中心炭素に結合している球は,具体的な原子でなく,色が異なる球は異なる原子・置換基の略記と考えてください.
一番下の段の2つが異なったものであることがわかったでしょうか? 実際の炭素化合物でも,4本の結合の手にそれぞれ異なった原子・置換基が結合している場合は異なった化合物と考えられ,お互いを『光学異性体』(鏡像異性体)と呼びます.また,そのような炭素を『不斉炭素原子』といい,不斉炭素原子を複数持つ化合物もたくさんあります.天然の糖やアミノ酸などでは,一方の化合物だけが多い場合が少なくありません.
光学異性体の物理化学的な性質はほとんど同じですが,旋光性(直線偏光がその物質を透過するとき,偏光面が回転する現象)が異なります.回転方向が右回りの場合を右旋性(dextrorotatory)といい,d または + を付けて表わし,左回りの場合は左旋性(levorotatory)といって,l または - を付けて表わします.
結合する置換基の順位付けをして,その並び方の約束から定める区別もあり,R と S,あるいは旧来の D と L で分類する場合もあるので注意が必要です.例えば天然のアミノ酸はほとんど L-体です.
以下は,R,S の命名法の説明で用いられるグリセルアルデヒドの例です.
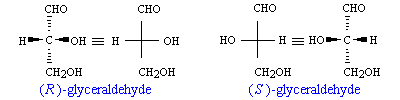
また以下は,代表的な光学異性体の乳酸です.